Strategie QA-RA nell’equipment management

Introduzione
Il costante miglioramento della qualità e delle aspettative di vita ha fatto crescere in modo considerevole la richiesta di beni e servizi nel settore Life Sciences, che risponde investendo costantemente nell’innovazione. La produzione e la commercializzazione di tali beni e servizi impongono stringenti requisiti regolatori in continua evoluzione nei Paesi in cui risiedono e operano le aziende del settore. Da ciò deriva un impianto normativo molto articolato e di conseguenza la necessità di definire nuove strategie per garantire la conformità ai regolamenti del mercato e agli standard nazionali ed internazionali, e per rispondere ai bisogni di salute e benessere dei cittadini.
I ruoli dei dipartimenti QA & RA
In questo contesto è fondamentale la cooperazione tra i dipartimenti Regulatory Affairs (RA) e Quality Assurance (QA) per garantire il rispetto dei regolamenti e delle normative di competenza. Precisamente:
- L’RA si interfaccia con le agenzie di regolamentazione regionali, nazionali e internazionali e promuove l’adeguamento dei protocolli interni al quadro normativo in evoluzione, al fine di presentare le richieste di autorizzazione in modo appropriato ed ottenerne il rilascio dalle agenzie.
- Il QA, con le procedure interne, incanala le risorse aziendali verso l’obiettivo comune di rispondere tempestivamente e in modo efficace alle esigenze che cambiano, con prodotti e soluzioni rispondenti ai target di qualità specifici.
L’esperienza QA & RA nella gestione degli strumenti
I processi di assicurazione qualità si basano sull’attività sperimentale. Per la continuità e l’efficienza di tali attività è necessario che gli strumenti utilizzati siano affidabili e duraturi. Pertanto è mandatorio che gli strumenti mantengano alta la conformità agli standard di utilizzo e di sicurezza attraverso un programma di cura e manutenzione costante. In questo contesto la divisione Life Sciences di ALTEN Italia ha collaborato con il dipartimento di QA&RA di una importante multinazionale, identificando e svolgendo attività con finalità preventive e ispettive sulla gestione degli strumenti.
Ai fini preventivi, abbiamo definito una procedura per eseguire un flusso ordinato di attività con i relativi input e output, con le parti interessate e con le relative responsabilità.
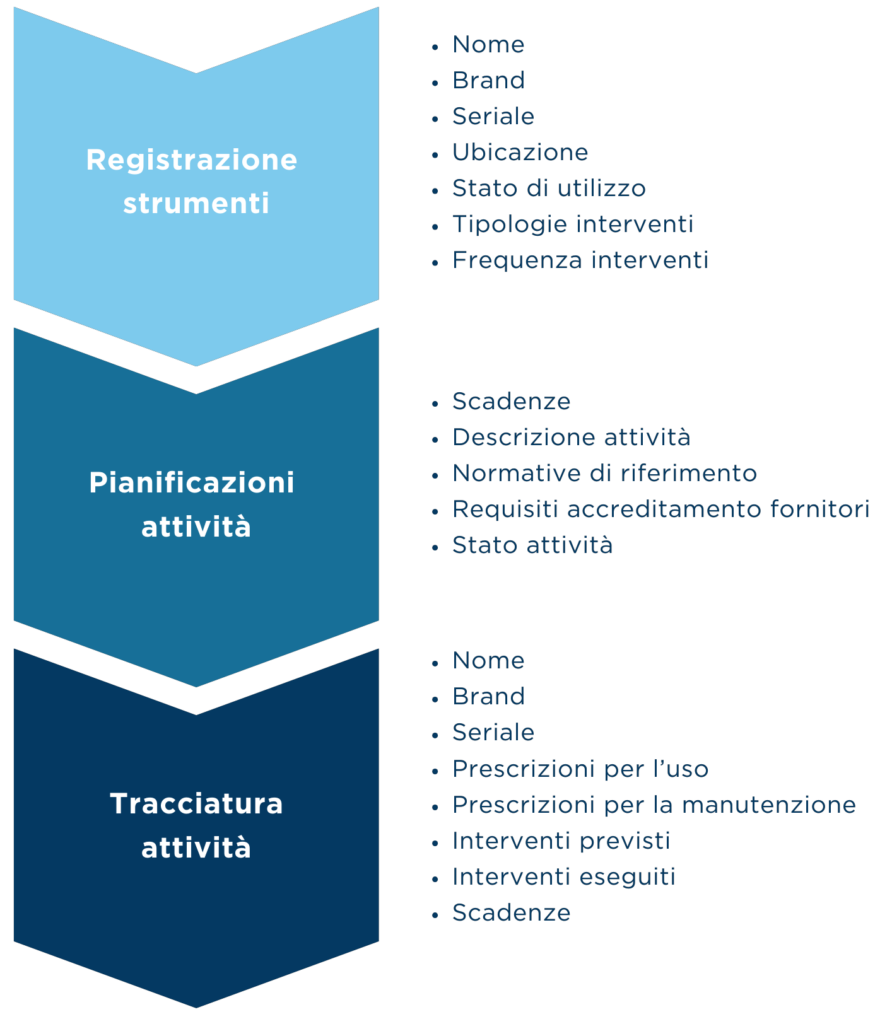
Ai fini ispettivi, abbiamo eseguito controlli nei laboratori per verificare:
- L’esecuzione corretta delle attività pianificate
- Il rispetto delle scadenze
- La tracciatura completa degli interventi eseguiti
- La conformità della reportistica alle norme di riferimento
- La conformità delle attività di archiviazione alle policy aziendali
- La formazione del personale.
Attraverso questi controlli abbiamo identificato le criticità residue e le abbiamo risolte con due interventi:
- Collegando il flusso di gestione degli strumenti con i flussi definiti per la gestione delle attività di:
- acquisti: per emettere ordini completi di tutte le specifiche tecniche, commerciali, logistiche, ecc. concordate con i fornitori
- installazione: per identificare e rispettare i vincoli dei locali e degli strumenti
- documentazione: per comporre e archiviare il corredo documentale inerente al servizio o strumento
- non conformità: per segnalare, analizzare e risolvere le eventuali deviazioni identificate nel corso delle attività
- Introducendo i processi di:
- Qualifica dell’installazione: per dimostrare l’adeguatezza degli strumenti ai requisiti del cliente, alle normative e agli standard in vigore
- Decontaminazione: per dimostrare la sterilità agli operatori della manutenzione prima degli interventi
Il processo di qualifica dell’installazione
In collaborazione con i fornitori degli strumenti e con gli utilizzatori, ALTEN Italia ha partecipato alle fasi di:
- Definizione e controllo dei protocolli per individuare e ottimizzare i parametri di processo inerenti alla qualifica dell’installazione IQ, dell’operatività OQ e della performance PQ
- Esecuzione delle attività per garantire il rispetto delle specifiche di:
- Montaggio, posizionamento e collegamento alle fonti di energia (IQ)
- Funzionamento all’interno dei range stabiliti (OQ)
- Efficacia e riproducibilità nelle condizioni reali di utilizzo (PQ)
Il processo di decontaminazione
Un dispositivo medico si dice sterile quando è privo di microrganismi vitali. Poiché questa condizione non è praticamente realizzabile, dal punto di vista operativo si considera sterile lo stato in cui la sopravvivenza di un microrganismo è estremamente improbabile. Pertanto l’obiettivo del processo di sterilizzazione è quello di ridurre la probabilità ai valori minimi che ne consentano l’utilizzo rispetto alle normative vigenti, attraverso metodologie ripetibili, standardizzabili e documentabili. Tale valore minimo è il livello di sicurezza di sterilità (Safety Assurance Level). Per i dispositivi medici la norma UNI EN ISO 11135:2020 (Sterilizzazione dei prodotti sanitari – Ossido di etilene – Requisiti per lo sviluppo, la convalida e il controllo sistematico di un processo di sterilizzazione per dispositivi medici) richiede un valore di SAL uguale a 10-6. Per raggiungere questo obiettivo abbiamo dovuto superare le seguenti difficoltà:
- Eterogeneità dei materiali coinvolti
- Molteplicità dei possibili interventi
- Complessità della normativa di riferimento
Quindi abbiamo eseguito uno studio di fattibilità con esperti del settore per esaminare le specifiche necessità del cliente, i costi e le probabilità di successo. Abbiamo scelto il processo di sterilizzazione con ossido di etilene perché questo gas:
- si diffonde attraverso l’imballaggio e raggiunge facilmente le superfici del prodotto
- è compatibile con un’ampia gamma di polimeri, resine, materiali naturali e metalli
- lascia integri la confezione e il prodotto
- non conferisce tossicità.
Risultati
Oltre il 90% degli interventi programmati sono stati eseguiti nei tempi previsti, dimostrando l’efficacia del processo definito da ALTEN Italia e garantendo la continuità di lavoro. Sono state anche messe a punto strategie che hanno progressivamente ridotto i costi sostenuti e il numero di risorse impiegate per completare le attività, aumentando così l’efficienza del processo. Questo successo è il risultato della progettazione di un flusso di lavoro basato su:
- una sequenza di attività sostenibili per gli stakeholder, perché costituite da operazioni chiare e coese
- un sistema di tracciamento efficace, perché realizzato attraverso moduli tra loro correlati e di facile utilizzo, idonei a tenere sotto controllo le attività.
Articolo a cura di R. Caradonna